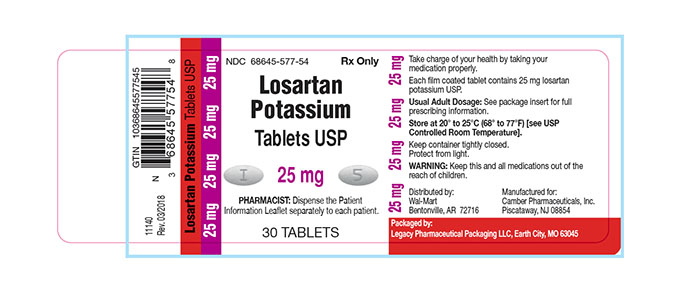
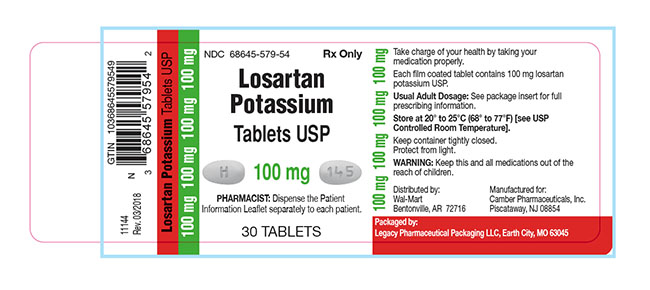
Theo dòng sự kiện thu hồi thuốc chứa nhóm sartan trên toàn thế giới, FDA vừa có thông báo Legacy Pharmaceutical Packaging, LLC đang thu hồi 40 lô thuốc viên nén Losartan Kali USP 25mg, 50mg,100mg ở cấp độ người tiêu dùng do nhiễm tạp chất N-Nitroso N-Methyl 4-Amino Butyric Acid (NMBA)
Lần thu hồi này được thực hiện ngay sau khi Camber Pharmaceuticals, Inc. thông báo thu hồi các biệt dược chứa losartan trên phạm vi toàn lãnh thổ Hoa Kỳ do phát hiện thấy dấu vết của tạp chất N-Nitroso N-Methyl 4-Amino Butyric Acid (NMBA), một tạp chất có thể được hình thành trong quá trình sản xuất hoặc từ nguyên liệu sản xuất nhiễm tạp. Các lô thuốc này được sản xuất bởi Hetero Labs Limited.
NMBA là một chất gây ung thư ở người. Đến nay, Legacy chưa nhận được báo cáo về các phản ứng có hại nào liên quan tới các thuốc bị thu hồi lần này.
Losartan Kali USP là một thuốc kê đơn sử dụng để điều trị tăng huyết áp, suy tim xung huyết và được đóng gói trong lọ 30 viên. Thông tin về tên sản phẩm, số đăng ký, hàm lượng, số lô, hạn sử dụng xin tham khảo trong nguồn dẫn.
Các lô thuốc trên được phân phối tại các nhà thuốc trên toàn quốc. Legacy Pharmaceutical Packaging LLC đang thông báo tới các nhà phân phối và người tiêu dùng thông tin chi tiết về việc thu hồi sản phẩm qua thư thu hồi
NMBA là một chất gây ung thư ở người. Đến nay, Legacy chưa nhận được báo cáo về các phản ứng có hại nào liên quan tới các thuốc bị thu hồi lần này.
Losartan Kali USP là một thuốc kê đơn sử dụng để điều trị tăng huyết áp, suy tim xung huyết và được đóng gói trong lọ 30 viên. Thông tin về tên sản phẩm, số đăng ký, hàm lượng, số lô, hạn sử dụng xin tham khảo trong nguồn dẫn.
Các lô thuốc trên được phân phối tại các nhà thuốc trên toàn quốc. Legacy Pharmaceutical Packaging LLC đang thông báo tới các nhà phân phối và người tiêu dùng thông tin chi tiết về việc thu hồi sản phẩm qua thư thu hồi
Nguồn: https://www.fda.gov/Safety/Recalls/ucm633664.htm
Người tổng hợp: Đỗ Thu Thanh - Nguyễn Phương Thúy