Thông tin chính
- Một nghiên cứu an toàn sau cấp phép (Giám sát ORAL) đã cho thấy nguy cơ gia tăng biến cố tim mạch (MACE), bệnh ác tính, huyết khối và tử vong khi sử dụng tofacitinib, một thuốc ức chế Janus Kinase (JAK) so với thuốc ức chế yếu tố hoại tử khối u (TNF) ở những bệnh nhân viêm khớp dạng thấp từ 50 tuổi trở lên và có ít nhất một yếu tố nguy cơ tim mạch kèm theo.
- Các thuốc ức chế JAK sử dụng trong các trường hợp viêm có thể có nguy cơ tương tự như đã quan sát với tofacitinib trong nghiên cứu giám sát ORAL.
- HSA đã tiến hành đánh giá mối liên quan lợi ích - nguy cơ và đưa ra kết luận rằng thông tin lợi ích - nguy cơ của thuốc ức chế JAK trong điều trị các tình trạng viêm nhiễm vẫn phù hợp đối với các chỉ định đã được phê duyệt tại Singapore.
- Nhân viên y tế được khuyến cáo cần cân nhắc lợi ích và nguy cơ của các thuốc ức chế JAK trước khi tiến hành kê đơn, đồng thời theo dõi các nguy cơ tiềm ẩn ở bệnh nhân trong suốt quá trình điều trị, đặc biệt là ở người cao tuổi, đã hoặc đang hút thuốc, những người có yếu tố nguy cơ mắc bệnh tim mạch, bệnh ác tính hoặc huyết khối tắc mạch khác.
HSA đã hoàn thiện đánh giá về nguy cơ xảy ra biến cố bất lợi về tim mạch (MACE), bệnh ác tính, huyết khối và tử vong khi sử dụng các thuốc ức chế Janus Kinase (JAK) trong điều trị các trường hợp viêm. Đánh giá đã được tiến hành dựa trên những phát hiện từ nghiên cứu an toàn sau cấp phép (Giám sát ORAL), đã cho thấy nguy cơ gia tăng phản ứng có hại khi sử dụng tofacitinib so với các thuốc ức chế yếu tố hoại tử khối u (TNF) ở những bệnh nhân viêm khớp dạng thấp (RA) từ 50 tuổi trở lên và có ít nhất một yếu tố nguy cơ tim mạch kèm theo.
Dựa trên các thông tin hiện có, sau khi tham khảo ý kiến của Ủy ban Cố vấn Cảnh Giác Dược (PVAC), HSA đã đưa ra kết luận rằng thông tin lợi ích - nguy cơ của thuốc ức chế JAK trong điều trị các tình trạng viêm vẫn phù hợp với các chỉ định được phê duyệt tại những nơi giới hạn sử dụng thuốc ức chế JAK là liệu pháp điều trị hàng 2 hoặc điều trị muộn ở Singapore. Đối với các thuốc ức chế JAK khác được sử dụng để điều trị tình trạng viêm có thể có những nguy cơ tương tự như đã quan sát được với tofacitinib ở nghiên cứu giám sát ORAL, nhân viên y tế cần cân nhắc lợi ích và nguy cơ của thuốc ức chế JAK trước khi kê đơn, theo dõi những nguy cơ tiềm ẩn của người bệnh trong suốt thời gian điều trị, đặc biệt là người cao tuổi, đã hoặc đang hút thuốc, những người có yếu tố nguy cơ mắc bệnh tim mạch, bệnh ác tính hoặc huyết khối tắc mạch khác.
Các thuốc ức chế JAK được phê duyệt tại Singapore
Thuốc ức chế JAK là thuốc ức chế miễn dịch được sử dụng trong điều trị viêm như viêm khớp dạng thấp, viêm khớp vẩy nến, viêm cột sống dính khớp, viêm loét đại tràng và viêm da dị ứng. Các thuốc ức chế JAK được phê duyệt tại Singapore trong điều trị viêm là Xeljanz®, Pfizer Private Limited (tofacitinib), Olumiant®, DKSH Singapore Pte. Ltd. (baricitinib), Rinvoq®, AbbVie Pte. Ltd. (upadacitinib) và Cibinqo®, Pfizer Private Limited (abrocitinib). Các thuốc ức chế JAK khác không được chỉ định trong điều trị viêm (như ruxolitinib) không ở trong phạm vi đánh giá lợi ích - nguy cơ của HSA.
Nghiên cứu giám sát thuốc điều trị viêm khớp dạng thấp đường uống (ORAL)
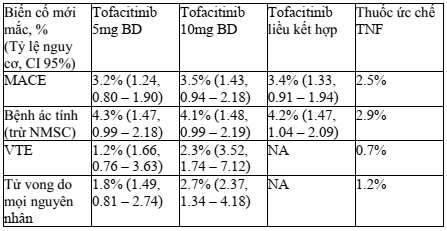
Thử nghiệm ORAL ngẫu nhiên, nhãn mở, không thua kém đánh giá độ an toàn của tofacitinib ở 2 liều (5mg và 10mg, ngày 2 lần) so với thuốc ức chế TNF ở bệnh nhân RA được điều trị bằng methotrexat (MTX). Tiêu chuẩn lựa chọn là bệnh nhân từ 50 tuổi trở lên và có ít nhất một yếu tố nguy cơ tim mạch kèm theo. Các tiêu chí đánh giá chính là MACE và bệnh ác tính (không bao gồm ung thư da không u sắc tố (NMSC)). Tính không thua kém của tofacitinib sẽ được chứng minh nếu giới hạn trên khoảng tin cậy (CI) 95% hai phía của tỷ số nguy cơ giữa tofacitinib liều kết hợp so với thuốc ức chế TNF nhỏ hơn 1,8.
Có tất cả 4326 đối tượng được phân ngẫu nhiên để điều trị với một trong các liều tofacitinib 5mg 2 lần mỗi ngày (n=1455), tofacitinib 10mg 2 lần mỗi ngày (n=1456), hoặc thuốc ức chế TNF (n=1451). Nhìn chung các đặc điểm nhân khẩu học và lâm sàng nền của bệnh nhân giống nhau giữa các nhóm thử nghiệm. Hầu hết đối tượng tham gia là nữ (78%) và da trắng (76.9%), độ tuổi trung bình là 61 tuổi (trung vị 60 tuổi, kéo dài từ 50 tới 88 tuổi). Vào tháng 2 năm 2019, bệnh nhân điều trị với liều tofacitinib 10mg 2 lần mỗi ngày được chuyển sang liều thấp hơn 5mg 2 lần mỗi ngày, sau phân tích tạm thời nghiên cứu, ghi nhận được tỷ lệ mới mắc bệnh thuyên tắc phổi và tử vong ở những bệnh nhân sử dụng tofacitinib 10 mg 2 lần mỗi ngày cao hơn bệnh nhân sử dụng tofacitinib 5mg 2 lần mỗi ngày hoặc thuốc ức chế TNF. Thời gian theo dõi trung vị là 4 năm và bệnh nhân được phân tích ở nhóm chỉ định ban đầu của họ, bao gồm cả những người chuyển từ nhóm tofacitinib 10mg sang 5mg 2 lần mỗi ngày.
Trong phân tích cuối cùng, dựa theo các tiêu chí chính là MACE và bệnh ác tính (không bao gồm NMSC) (Bảng 1) sử dụng tofacitinib liều kết hợp không được chứng minh là không kém hơn so với sử dụng thuốc ức chế TNF. Tỷ lệ mới mắc MACE và bệnh ác tính đối với liều kết hợp tofacitinib cao hơn so với sử dụng thuốc ức chế TNF (tỷ số nguy cơ tương đối 1,33 (CI 95%: 0,91 - 1,94) và 1,47 (CI 95%: 1,04 - 4,09)). Dấu hiệu bệnh ác tính chủ yếu đến từ sự gia tăng tỷ lệ mới mắc ung thư phổi và ung thư hạch. Thuyên tắc huyết khối tĩnh mạch (VTE) và tử vong do mọi nguyên nhân được xác định thường xảy ra khi sử dụng cả 2 liều tofacitinib hơn so với khi sử dụng thuốc ức chế TNF. Nguy cơ gia tăng MACE, VTE và tử vong phụ thuộc vào liều đã được ghi nhận trên cả 2 liều tofacitinib hơn so với thuốc ức chế TNF. Trong phân tích nhóm được phân tầng theo độ tuổi, trong các nhóm thử nghiệm tỷ lệ mới mắc MACE và bệnh ác tính ở nhóm bệnh nhân từ 65 tuổi trở lên cao hơn so với nhóm dưới 65 tuổi. Trong số những bệnh nhân từ 65 tuổi trở lên, cả hai liều tofacitinib đều có liên quan đến nguy cơ mắc MACE và bệnh ác tính cao hơn so với khi dùng thuốc ức chế TNF.
Bảng 1: Tỷ lệ mới mắc biến cố bất lợi và tỷ lệ nguy cơ
Động thái của các Cơ quan quản lý Dược phẩm trên thế giới
Các Cơ quan quản lý y tế trên thế giới, cụ thể là Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA), Cơ quan quản lý Dược phẩm Châu âu (EMA) và Cơ quan quản lý y tế Canada (Health Canada) đã tiến hành đánh giá an toàn trong bối cảnh rủi ro gia tăng quan sát được ở tofacitinib trong nghiên cứu giám sát ORAL. Ngoài tofacitinib, các đánh giá an toàn cũng tiến hành với các thuốc ức chế JAK dùng để điều trị viêm khác.
(a) Xeljanz® (Tofacitinib)
Các cơ quan quản lý tiến hành đánh giá về nguy cơ gia tăng MACE, bệnh ác tính và huyết khối giữa tofacitinib so với các thuốc ức chế TNF. Kết quả cho thấy, cả 3 cơ quan quản lý đều khuyến cáo nên cập nhật những cảnh báo về các những nguy cơ gia tăng trong nghiên cứu giám sát ORAL lên bao bì của tofacitinib. Ngoài ra, FDA Hoa Kỳ và Health Canada khuyến cáo thay đổi các chỉ định đã được phê duyệt của tofacitinib. FDA Hoa Kỳ giới hạn tất cả các chỉ định đã được phê duyệt của tofacitinib cho những bệnh nhân có đáp ứng không đầy đủ hoặc không dung nạp với một hoặc nhiều thuốc ức chế TNF, trong khi đó Health Canada giới hạn sử dụng tofacitinib cho bệnh nhân RA có đáp ứng không đầy đủ hoặc không dung nạp với MTX và với ít nhất một thuốc chống thấp khớp tác dụng chậm khác.
(b) Các thuốc ức chế JAK khác dùng để điều trị viêm
FDA Hoa Kỳ, EMA và Health Canada đã kết luận rằng các thuốc ức chế JAK khác được sử dụng để điều trị viêm (như baricitinib và upadacitinib) có thể xảy ra những nguy cơ tương tự như đã quan sát được ở tofacitinib trong nghiên cứu giám sát ORAL. FDA Hoa Kỳ đã mở rộng cảnh báo và giới hạn sử dụng tofacitinib và các thuốc ức chế JAK khác được sử dụng trong điều trị viêm nhiễm, mặt khác, Health Canada và EMA chỉ khuyến cáo cập nhật cảnh báo về nguy cơ đã quan sát được với tofacitinib trong nghiên cứu giám sát ORAL mà không thay đổi các chỉ định đã được phê duyệt.
Các báo cáo về biến cố bất lợi MACE, bệnh ác tính, huyết khối và tử vong khi sử dụng thuốc ức chế JAK ở địa phương
Đến nay HSA đã ghi nhận được 2 báo cáo về biến cố bất lợi là ung thư vú và tử vong khi sử dụng tofacitinib. Biến cố ung thư vú được đơn vị báo cáo đánh giá là một tình trạng y tế xuất hiện lặp đi lặp lại không liên quan đến việc điều trị bằng tofacitinib, trong khi đó có các yếu tố gây nhiễu (sử dụng đồng thời các tác nhân hóa trị liệu khác) đã xuất hiện trong trường hợp tử vong sau nhiễm trùng. HSA cũng ghi nhận được một báo cáo biến cố bất lợi về đột quỵ liên quan đến sử dụng thuốc upadacitinib. Tuy nhiên biến cố đột quỵ được đánh giá là không liên quan đến việc điều trị bằng upadacitinib và bệnh nhân sau đó đã được tái điều trị RA với cùng thuốc ức chế JAK đó mà không gặp phải vấn đề gì. Không có báo cáo biến cố bất lợi nào về việc xuất hiện MACE, bệnh ác tính, huyết khối hoặc tử vong khi sử dụng baricitinib và abrocitinib tại các địa phương.
Đánh giá về lợi ích - nguy cơ của HSA
Đánh giá lợi ích - nguy cơ của HSA đã được xem xét từ các phát hiện trong nghiên cứu giám sát ORAL, thông tin được cung cấp bởi các công ty dược, việc sử dụng thuốc ức chế JAK tại các địa phương, ý kiến chuyên môn của các bác sĩ tại địa phương (bác sĩ thấp khớp, bác sĩ tiêu hóa, bác sĩ da liễu) và hoạt động pháp lý được thực hiện bởi các cơ quan quản lý quốc tế. Dựa trên những thông tin có sẵn, cùng với sự tư vấn của PVAC, HSA đã đánh giá thông tin lợi ích - nguy cơ của thuốc ức chế JAK vẫn phù hợp đối với các chỉ định đã được chấp thuận tại Singapore - nơi thuốc ức chế JAK đã được giới hạn là thuốc điều trị hàng hai hoặc điều trị muộn. Cơ chế xuất hiện các biến cố bất lợi này vẫn chưa được biết đến, vậy nên không thể loại trừ nguy cơ xảy ra biến cố bất lợi khi sử dụng các thuốc ức chế JAK khác vì chúng có cơ chế hoạt động tương tự nhau.
Khuyến cáo và hành động của HSA
Nhân viên y tế được khuyến cáo cân nhắc về lợi ích và nguy cơ của các thuốc ức chế JAK trước khi kê đơn, theo dõi các nguy cơ tiềm ẩn của bệnh nhân trong suốt quá trình điều trị, đặc biệt là ở người cao tuổi, đã hoặc đang hút thuốc, có yếu tố nguy cơ mắc bệnh tim mạch, bệnh ác tính hoặc huyết khối tắc mạch khác.
HSA đã ban hành công văn cho nhân viên y tế thông báo về những khuyến cáo và hành động của HSA sau khi đánh giá lợi ích - nguy cơ của thuốc ức chế JAK vào ngày 17 tháng 11 năm 2022. HSA đang làm việc với bên đăng ký thuốc để bổ sung thêm các cảnh báo về nguy cơ gia tăng tình trạng MACE, bệnh ác tính, huyết khối và tử vong quan sát được trong nghiên cứu giám sát ORAL trên bao bì các thuốc ức chế JAK điều trị tình trạng viêm nhiễm. HSA sẽ tiếp tục theo dõi sát diễn biến quốc tế và trong nước về vấn đề này và cập nhật cho các nhân viên y tế khi có bất kỳ phát hiện quan trọng nào.
Khuyến khích nhân viên y tế báo cáo tất cả các biến cố bất lợi nghiêm trọng nghi ngờ liên quan đến việc sử dụng thuốc ức chế JAK cho bộ phận Cảnh giác và Tuân thủ của HSA.
Điểm tin: CTV. Nguyễn Phương Thảo, CTV. Đặng Thùy Tiên
Phụ trách: ThS.DS. Nguyễn Thị Tuyến